研究内容
プロジェクト1(臓器間連携)
低タンパク質食を給餌した動物では、IGF産生・分泌量が低下し、特に筋肉のIGFシグナルが遮断されるためタンパク質同化の抑制が起こって、成長期には動物の成長の遅滞が、成長期以降は体から窒素の損失が起こることになります。この際、インスリンの血中濃度が低いにもかかわらず、血糖値は正常で、インスリンの感受性は高まっていました。しかし一方で、肝臓には脂肪の蓄積が観察されます。一般にインスリン抵抗性と脂肪肝は関連していることが知られていますが、今回の研究成果はその結果と反するものでした。当初は、この様な現象が起きるメカニズムとして、低タンパク質食でタンパク質代謝が低下するためにエネルギー消費が下がり、エネルギー源としての糖が余剰となりますが、肝臓では何らかの機構でインスリンシグナルの活性が増強されるために、糖の利用がさかんになり、結果として糖を脂肪にして蓄積するのではないかと考えました。
(現在では肝臓細胞自体が細胞外のアミノ酸濃度を感知して脂肪合成を促進するという仕組みが存在していることを明らかにしており、低タンパク食給餌による脂肪肝形成にはインスリンシグナルの関与しない未知のメカニズムが存在しているのではないかと考えています)。
低タンパク質栄養状態の子供はクワシオルコールという病態に陥り、肝腫大を引き起こすことは広く知られていますが、私たちは、この肝腫大は私たちが見出したこのメカニズムによるものではないかと考えています。
更に驚いたことに、筋肉では、IGFシグナル系はmTORというシグナル系下流で抑制されているのですが、インスリンの初期シグナル系はむしろ増強され、その結果、糖取り込みも上昇していました。これは、他の臓器で糖利用が減少すると、血中の糖を取り込んで肝臓に貯蔵するという補償作用が働いているためと説明できます。これまで飢餓をずっと経験してきた動物の緻密な臓器間連携による代謝制御ということもできるかもしれません。
一体、このような臓器間連携というのは、何が刺激になって、どういう仕組みで起こっているのでしょうか?これも私たちが興味を持っているテーマです。
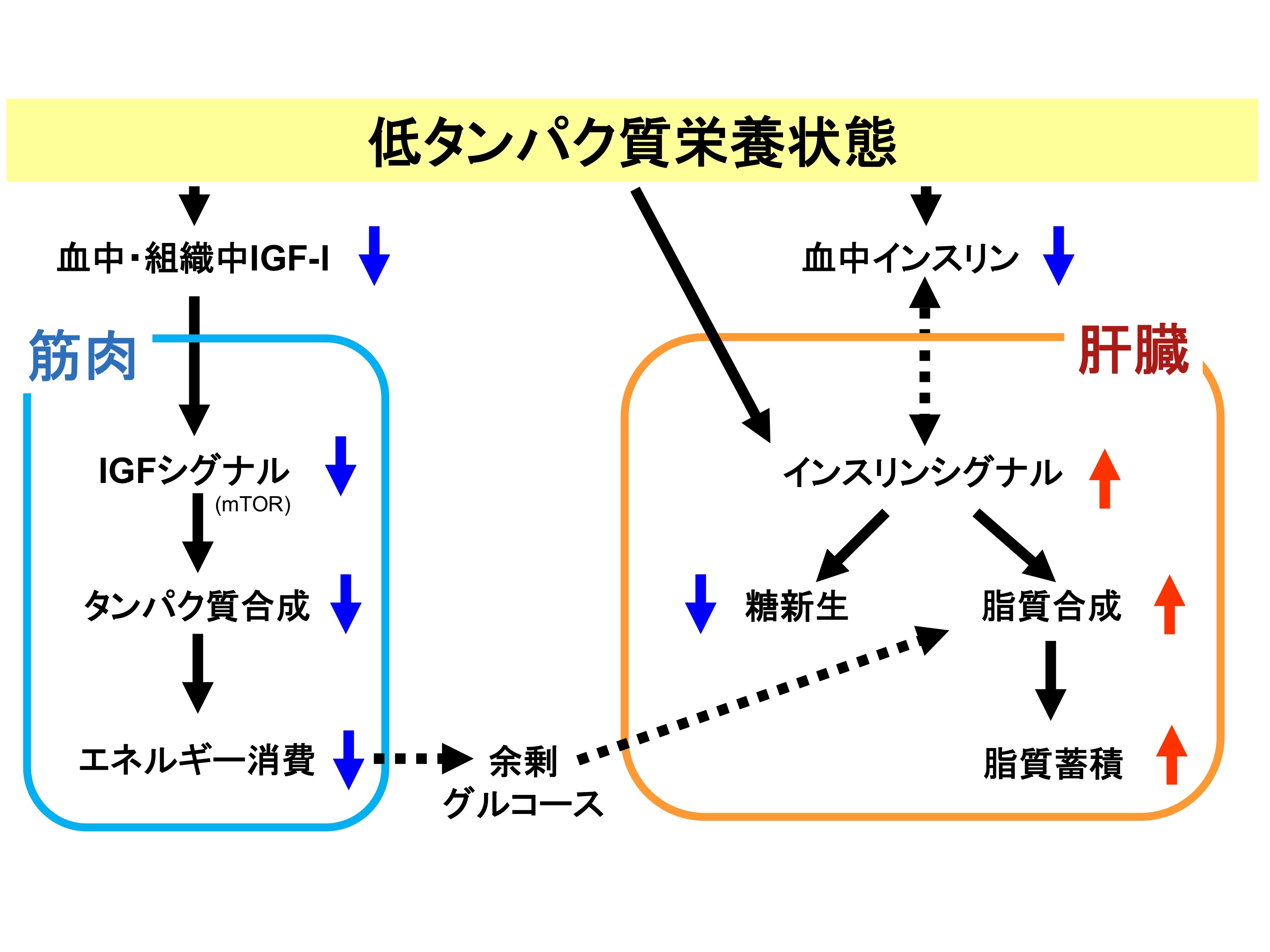
低タンパク質を給餌された動物では、筋肉でのタンパク質同化が阻害、そのためエネルギー消費が減少する。エネルギー消費が減少したために余剰となったグルコースは肝臓などにとりこまれ、脂質合成系により脂質に変えられ、肝臓に脂質蓄積が起こる。タンパク質栄養の変化を糖・脂質代謝を利用してエネルギーの恒常性を維持する機構ということができるが、どのようなシグナル伝達系により、このような現象が引き起こされるのかは今後の研究課題である。
| 研究内容:目次 | プロジェクト1(AI Nutrition) 戻る 次へ プロジェクト1(高品質食資源) |