研究内容
プロジェクト4(1)
臓器間連携によるインスリン様活性の調節メカニズムを知る
私たちは、ヒトGHを過剰発現したトランスジェニックラットを用いた共同研究で、高いGH血中濃度により脂肪組織・筋肉でインスリン抵抗性が起こると、肝臓細胞でインスリンシグナルが増強され糖利用が増加、その結果、肝臓の糖の取り込みが増加することを見つけました。これは、脂肪組織・筋肉におけるインスリン作用不足を、肝臓が補償する、あるいは余った糖を無駄にせず保存するという機構と考えることができます (図20)。 これらの結果は、先に紹介したように脂肪細胞と筋肉細胞というような隣り合わせの臓器連携ばかりではなく、血流を介した臓器連携によっても糖代謝の正常化が可能となっていることを示しています。肝臓細胞では、IRS-1ではなく、IRS-2のインスリン依存性チロシンリン酸化の増強が観察されており、これまでの実験では、IRS-2に相互作用するタンパク質がチロシンリン酸化の増強に関わっていることもわかってきており、このタンパク質の同定もこれからの課題です。
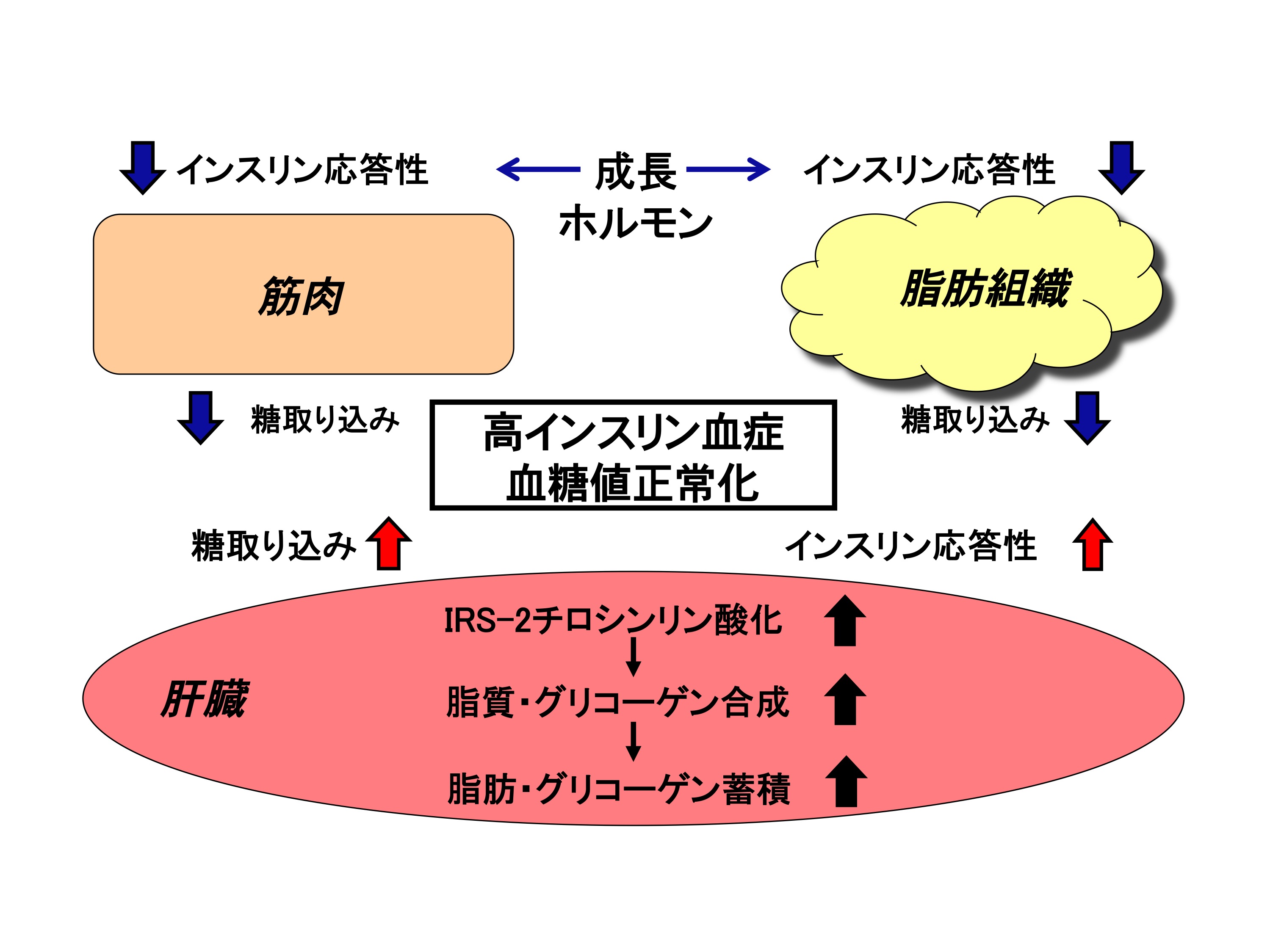
ヒト成長ホルモン過剰発現ラットの脂肪細胞、筋肉では、インスリン抵抗性が起こっており、糖の取り込みが抑制されている。そのために、動物は高インスリン血症を示すが、血糖値は正常である。この際、肝臓では、基底状態の糖取り込みが増加している上、インスリン応答性が上昇しており、取り込んだ糖を脂肪・グリコーゲンとして肝臓に蓄積させる結果、血糖値が正常に保たれている。このように、ある臓器でインスリン抵抗性を起こしていても、他の臓器がこれを補償し、代謝を正常化、生命を維持するという機構が稼働していることが明らかとなってきた。このような臓器連携による代謝維持機構を解明することは、代謝病の新しい治療法や治療薬を開発するために重要な観点といえる。
| 研究内容:目次 | プロジェクト3(4) 戻る 次へ プロジェクト4(2) |