研究内容
プロジェクト4(IRS結合タンパク質)
私たちは、これまでに30種類以上のIRSと相互作用するタンパク質の同定に成功しています。同定されたタンパク質は、1)IRSの細胞内局在を決定する、2)レセプターキナーゼによるIRSのチロシンリン酸化を調節する、3)未知の新しいシグナル経路を仲介する、4)IRSの品質管理に関わる、機能を有していることが明らかになりました(Hakuno et al. J.Mol.Endo. 2018、Hakuno et al. Front. Endo. 2015)。
IRS結合タンパク質によるインスリン様シグナルの制御
53BP2S(Hakuno et al. JBC 2007)、Nedd4(Fukushima et al. Nat. Commun. 2015)、HSP90(Fukushima et al. Mol.Cell.Endo. 2011)、USP15(Fukushima et al. BBRC 2017)、GKAP42(Ando et al. JBC 2015)は、IRSと相互作用することでIRSのチロシンリン酸化を修飾することを明らかにしました。また、USP9X(Furuta et al. Oncotarget 2018)、USP7(Yoshihara et al. BBRC 2012)、SCFb-TRCP(Yoneyama et al. iScience 2018)、はIRSと結合することでIRSの品質管理をしていました。また、AP1(Yoneyama et al. eLife 2018)、importinβ(Kabuta et al. BBRC 2008)はIRSの細胞内局在を制御していました。さらに、RNA代謝に関係する酵素や小胞輸送・細胞運動などに関わる分子など、これまで予想もしなかったタンパク質が含まれていました(Ozoe et al. FEBS Letter 2013、Ozoe et al. Front Endocrin. 2014)。そして、細胞外因子の刺激に応答して、IRSとそれぞれのIRS結合タンパク質の相互作用が変動する結果、IRSを介したシグナルの修飾が引き起こされ、IGFやインスリンの特定の生理活性の増強や阻害が起こると考えています。
IRS結合タンパク質から見えてきたIRSの新たな機能
私たちはインスリン様シグナルの活性制御ではなく、全く異なる機能を有するタンパク質の単離・同定にも成功しています。例えば、DGKζはIRS-1と結合することでGLUT4の細胞膜への移行を抑制しています(Liu et al. Sci. Rep. 2016)。IRS-1はAP1と結合することでIGF-I受容体の内在化を抑制し、IGF-Iシグナル活性の持続時間を調節しています。さらに、IRS-2は何らかのタンパク質と結合することによってPC3細胞においてMMP-9の分泌を、肝臓細胞においてVEGF-Dの分泌を誘導する活性を示していることを明らかにしており、これもIRS-2結合タンパク質との結合を介して機能が発揮されていると考えられます。
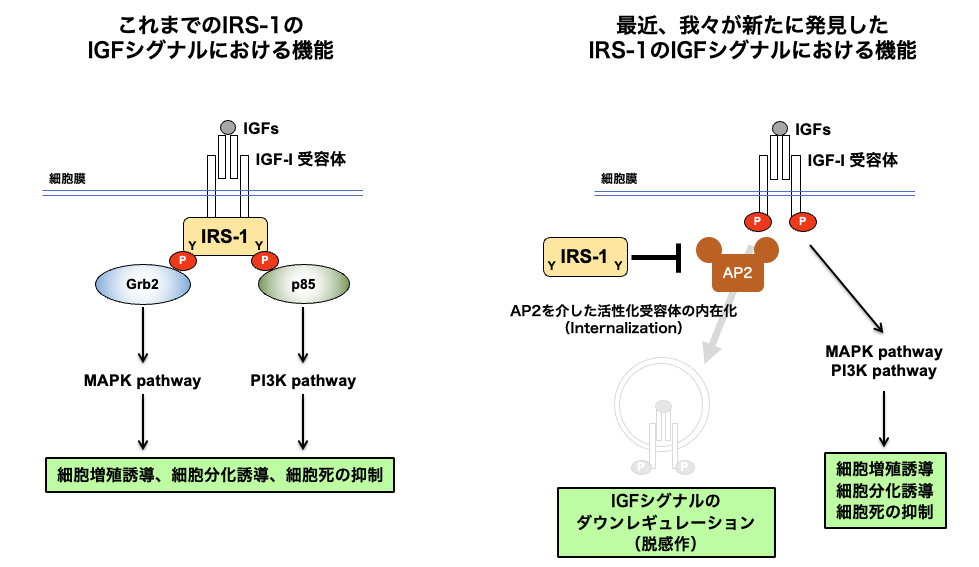
1. IRS1によるIGF-I受容体内在化制御
IRS-1はIGFシグナルを伝達するメディエータであるため、IRS-1を過剰発現するとIGFシグナルが増強されると考えられます。ところが、IRS-1を過剰発現してもIGFシグナルの活性の強度は変化せず、IGFシグナルの持続時間が長くなることがわかりました(Hakuno et al. PloS One 2011)。その詳細なメカニズムを調べるうちに、IRS-1はクラスリン被覆タンパク質AP2と結合して、その機能を阻害することで、IGF受容体の内在化及び分解を抑制していることを明らかにしました。そのため、IRS-1が過剰発現されると、AP2によるIGF-I受容体の内在化が阻害され、IGFシグナルが減弱されないため、IGFシグナルの活性持続時間が長くなります(Yoneyama et al. eLife 2018)。また、IRS-1はIGFシグナルの下流キナーゼであるmTORC1によってリン酸化され分解されることも明らかにしており(Yoneyama et al. iScience 2018)、mTORC1-IRS1-AP2-IGFIRというIGFシグナルの負のフィードバック制御が存在することを明らかにしました。
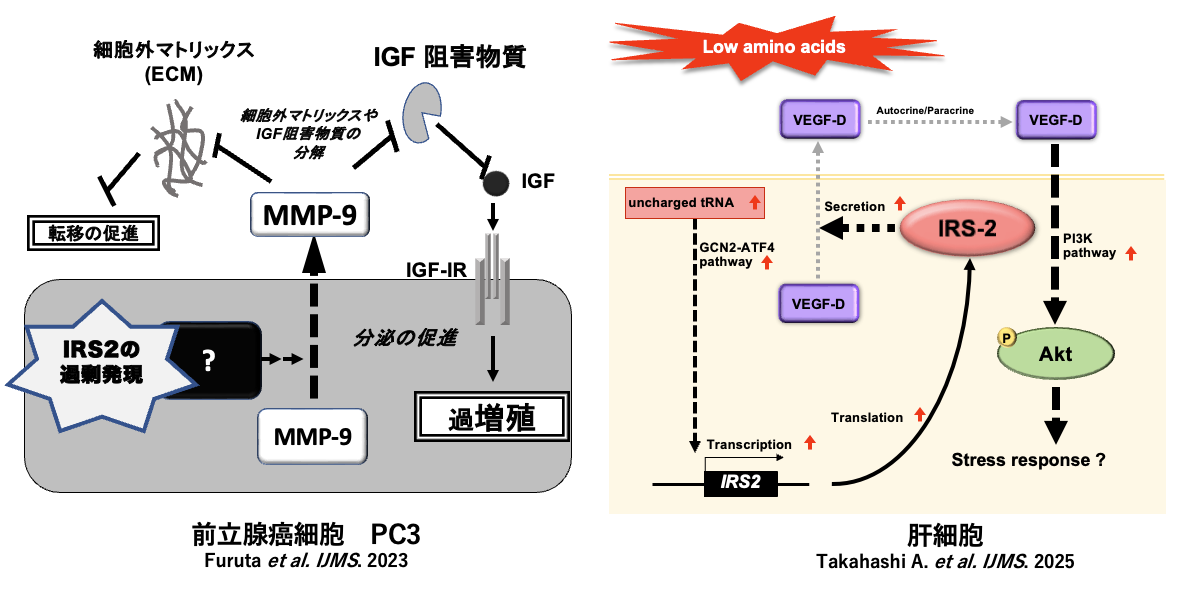
2. IRS2による分泌制御機構
これまでの私たちの研究から、前立腺がん細胞PC3においてIRS-2の発現が増加しておりIGF-Iシグナルが過剰に活性化されていることを示してきました。さらに、PC3において過剰に発現したIRS-2は、細胞外にマトリックスメタロプロテアーゼ(MMP)-9の分泌を促し、未知の機構でIGF-Iシグナルを活性化し、細胞の悪性度を高めていることを明らかにしました(Furuta et al. Int.J.Mol.Sci. 2023)。また、肝がん細胞であるHuH7をアミノ酸不含培地で培養するとIRS-2の発現量が増加し、血管新生成長因子であるVEGF-Dの細胞外への分泌が促進されていることを明らかにしました(Takahashi A. et al. Int.J.Mol.Sci. 2025)。さらに低タンパク食をラットに給餌すると肝臓でのIRS-2の発現が増加し、血中にVEGF-Dが分泌されてきます。この様にIRS-2にはさまざまなサイトカインやホルモンの分泌を制御する新たな機能を有している可能性が考えられました。
| 研究内容:目次 | プロジェクト4(2) 戻る 次へ プロジェクト4(4) |