研究内容
プロジェクト4(2)
IRS結合タンパク質の同定
前述したように、IRSのIGF/インスリン依存性チロシンリン酸化を修飾する機構として、IRSと相互作用するタンパク質が重要な役割を果たしていることを、私たちは発見しました。このような修飾反応が観察された細胞系、例えば甲状腺細胞、脂肪細胞、筋管細胞の細胞抽出液を調製後、穏和な条件でゲル濾過やNative Blueポリアクリルアミド電気泳動に供すると、IRSは自身の分子質量180kDaよりも高分子質量領域、600kDa以上の領域に存在することを示す結果は、IRSが他のタンパク質と相互作用をして、巨大なシグナル複合体(私たちは、これを「IRSome」と命名しました)を形成していることを示しています。実際、IRSに対する抗体で免疫沈降後、共免疫沈降物をSDS-ポリアクリルアミド電気泳動で分離しますと、多くのタンパク質のバンドが検出されます。
そこで、私たちは、IRSにチロシンリン酸化を介さないで相互作用するようなタンパク質の検索を、チロシンキナーゼをほとんど発現していない酵母を使ったtwo-hybrid screening、そして、抗IRS抗体でIRSとともに共免疫沈降されるタンパク質の網羅的解析により進めています(図)。 先にも述べたように、IRSファミリータンパク質として、これまでIRS-1からIRS-4の4つの分子種が報告されており、これらは、いずれもPHドメイン・PTBドメインという相同性の高い領域を有していますが、それ以外の領域については、アミノ酸配列の共通性が低いことがわかっています。そこで、それぞれのIRSに相互作用するIRS結合タンパク質を同定することにより、IRSの生理的意義の違いが明らかになると期待して、研究を進めています。
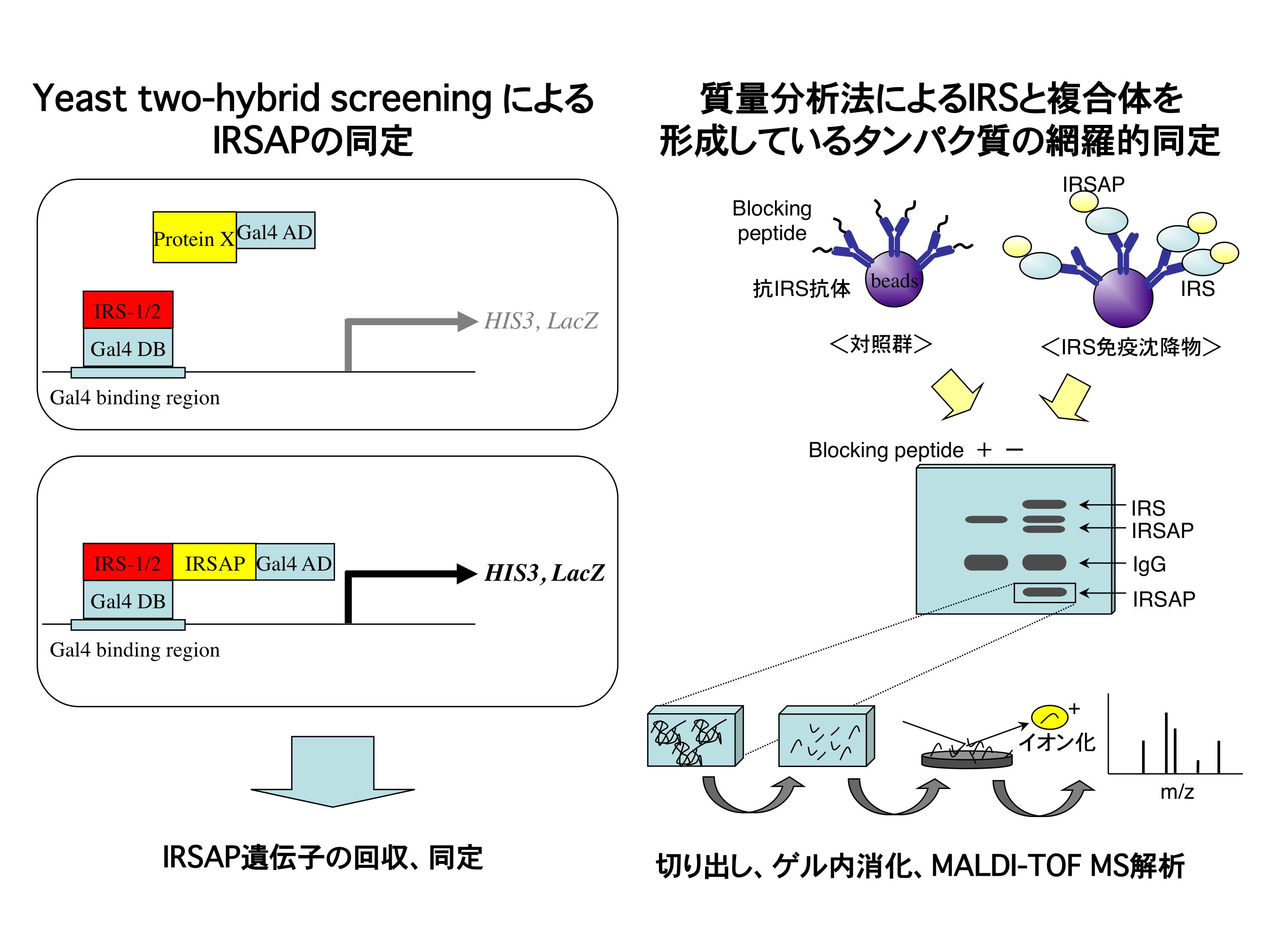
IRSと相互作用、あるいは複合体を形成しているタンパク質の同定 IRSと複合体を形成しているIRSAP(IRS-associated proteins) は、IRSを介したシグナルを修飾する機能を有していることが明らかとなってきたので、上記のような手法を用いて、これらのタンパク質の同定を薦め、これまでに30種類以上のタンパク質の同定に成功している。
| 研究内容:目次 | プロジェクト4(1) 戻る 次へ プロジェクト4(3) |