研究内容
プロジェクト3−2(6)
一方、3T3-L1脂肪細胞を成長ホルモン(GH)で長時間前処理すると、インスリン依存性の糖取り込みが抑制されますが、その際、インスリン依存性糖取り込みを担うGLUT4が細胞膜に移行していることは既にご紹介しました。これまで、GLUT4は細胞膜に移行すると直ちに糖を取り込むと考えられてきましたが (図14) 、今回の結果は、糖取り込みを起こすためには、たとえGLUT4が細胞膜移行としたとしても、インスリン刺激によって糖輸送機能が活性化される必要があることを示しています。最近になって、脂質代謝や食欲に関係しているレプチンというホルモンや高濃度のグルコースで培養すると、同様な現象が観察されることがわかってきており、糖取り込み抑制の新しい普遍的な仕組みと考えられます。GHで長時間処理後のインスリンシグナルを3T3-L1脂肪細胞で解析すると、受容体やIRS-1、IRS-2のインスリン依存性チロシンリン酸化には影響が観察されませんが、IRS-2と相互作用するPI 3-kinase活性が抑制されており、下流のセリン/スレオニンキナーゼであるAktの一部の基質のセリン/スレオニンリン酸化も減少していることが明らかとなりました。他の結果も併せ、IRS-2と相互作用するPI 3-kinaseの活性が細胞膜へ移動したGLUT4の糖透過活性の誘導に必須で、GHは、IRS-2と相互作用しIRS-2結合性PI 3-kinase活性を阻害するような分子を誘導する結果、糖輸送の抑制活性示すようになると考えています。現在、このタンパク質の同定を進めています。
先にご紹介したように、TNFαで長時間処理した3T3-L1脂肪細胞では、インスリン刺激に依存したIRS-1に結合したPI 3-kinaseの活性化が抑制されるためにGLUT4の細胞膜移行が阻害され、糖取り込みが起こらないことがわかっています。一方、プロジェクト3で説明しますように、IRS-1は主にエンドソームの回りに、IRS-2は細胞膜周辺を含め細胞質全体に広がって分布していることが明らかになり、この結果はIRS-1とIRS-2が異なる細胞内局在を示すと同時に異なる生理的意義を有している可能性を示しています。これらの結果を併せ、私たちは現在、インスリンの刺激がエンドソームの周辺のIRS-1のチロシンリン酸化を誘導、これに結合するPI 3-kinase活性がGLUT4の細胞膜への移行を引き起こし、細胞膜付近に存在するチロシンリン酸化されたIRS-2に相互作用しているPI 3-kinase活性が細胞膜上のGLUT4の糖透過活性を促進する結果、糖の取り込みが起こるという新しい機構を提唱しています (図15)。 このような機構が稼働しているとすれば、糖取り込みを増加させる方法としては、インスリンシグナルを増強させる以外にも、細胞膜移行したGLUT4の膜輸送活性を増加させるというアプローチも可能であると考えられます。膜透過活性促進剤が開発できれば、新しい抗糖尿病薬になることは言うまでもありません。今後、これらの研究を更に進め、インスリン抵抗性の新しい治療法や治療薬の開発に役立てたいと考えています。
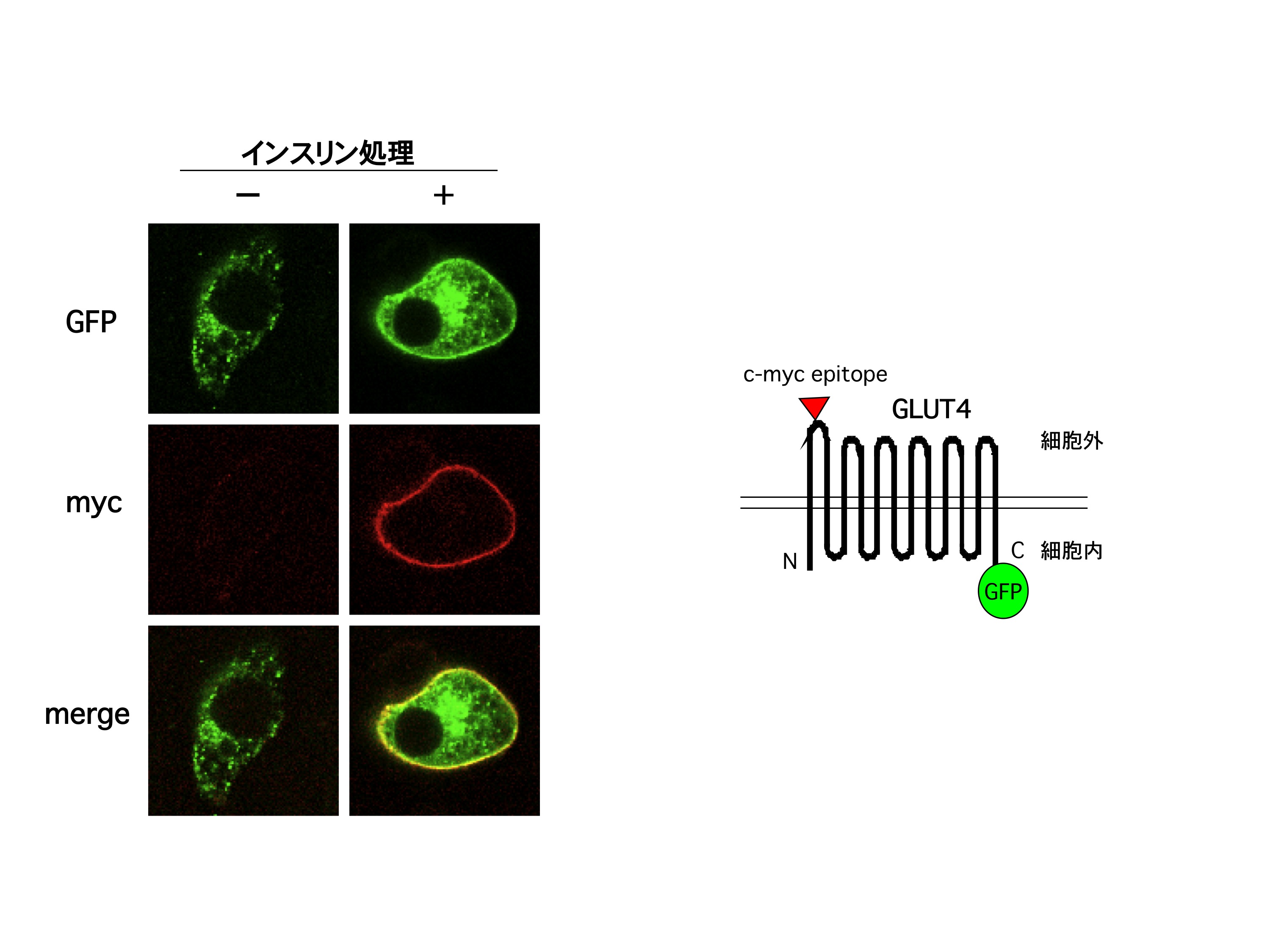
グルコース輸送体(GLUT)4は、12回膜貫通型のタンパク質で、細胞内小胞に存在している。インスリン刺激を引き金とするインスリンシグナルによりこの小胞が細胞表面に移行、細胞膜と融合することにより、細胞膜にGLUT4が露出し、糖を取り込むと考えられてきた。Jeff Pessin (Albert Einstein University) との共同研究で、GLUT4の細胞外ドメインにmycというタンパク質の部分を挿入、さらにC末端部分にはgreen fluorescence protein (GFP) を融合したタンパク質を、3T3-L1脂肪細胞に一過的に発現する方法を開発している。この遺伝子導入細胞をインスリンで刺激後、抗myc抗体で免疫染色後、共焦点蛍光顕微鏡で観察すると、インスリン刺激に依存して細胞膜が染まり、GLUT4が細胞膜へ移行していることが観察できる。細胞をあらかじめて種々のホルモンや薬剤で処理しておくことで、これらがGLUT4の細胞膜移行へ及ぼす影響を調べることができるわけである。

3T3-L1脂肪細胞においてIRS-1のインスリン依存性チロシンリン酸化とこれに続く結合性PI 3-kinaseの活性は、GLUT4の細胞膜への移行に、IRS-2のインスリン依存性チロシンリン酸化および相互作用するPI 3-kinaseの活性化は、細胞膜へ移行したGLUT4の糖輸送活性を誘導するのに、重要な役割を果たしている。この二つの経路が正常に稼働して、はじめてインスリン依存性糖の取り込みが起こる。
| 研究内容:目次 | プロジェクト3−2(5) 戻る 次へ プロジェクト4(1) |