研究背景
インスリン様シグナル(2)
それぞれのホルモンが、細胞膜上に存在するレセプターのαサブユニットに結合すると、βサブユニットに内蔵されているチロシンキナーゼが活性化し、いろいろな細胞内基質がリン酸化されます。レセプターチロシンキナーゼの生理的基質として、IRS (insulin receptor substrates)、Shcなどが明らかとなっています (図3)。 IRSには4つの分子種、IRS-1, 2, 3, 4が存在し、いずれも細胞膜中のリン脂質と結合するPHドメイン、リン酸化チロシン残基を含むモチーフを結合するPTBドメインを有し、C末端側にリン酸化されうるチロシン残基が多数持っています。後でも紹介しますように、C末端側の多様性が高いことから、それぞれのIRSは異なる生理的意義を有していると考えられます。これらの基質タンパク質は、自身が酵素活性を持たず、チロシンリン酸化部位を介して他のタンパク質と結合するドッキングタンパク質と考えられています。そして、チロシンリン酸化されたIRSは、チロシンリン酸化ペプチドを認識するSH2ドメインを有しているGrb2、PI 3-kinase (phosphatidylinositol 3-kinase) の85kDa調節サブユニットなどと結合することが明らかとなっています。一方、チロシンリン酸化されたShcも、Grb2と結合します。
Grb2は、プロリンに富んだ配列を認識して結合するSH3ドメインを2つ有しており、これらを介してSosと会合していることが明らかになっています。Sosは、Rasをはじめとした低分子量Gタンパク質をGDP型からGTP型に変換して活性化するGTP/GDP交換因子です。したがって、細胞膜付近に形成されるチロシンリン酸化IRS-Grb2-Sos複合体、チロシンリン酸化Shc-Grb2-Sos複合体は、細胞膜に局在しているRasを活性化するものと推定されています。活性化されたRasは、セリン/スレオニンキナーゼMAPKKK (mitogen-activated protein kinase kinase kinase)を活性化、これがMAPKK、最終的にMAP kinaseを活性化するというリン酸化カスケードを介して下流にシグナルを伝えます (図4)。
PI 3-kinaseは、イノシトールリン脂質であるPI類のイノシトール環の3位を特異的にリン酸化する酵素で、85kDa調節サブユニットと110kDa触媒サブユニットからなっています。SH2ドメインを介してPI3Kの調節サブユニットが、細胞膜付近に存在するチロシンリン酸化IRSと結合し触媒サブユニットが活性化されため、リガンド刺激により、細胞膜中にPI-3-リン酸誘導体が産生することになります。その結果、PI3-リン酸誘導体と相互作用する性質があるPHドメインを有しているシグナル分子、例えばAktやaPKCなどのセリン/スレオニンキナーゼが細胞膜に移行し、活性化されることが明らかとなりました。活性化されたキナーゼは、リン酸化カスケードを介して下流にシグナルを伝えます (図4)。 糖の膜透過を引き起こすグルコーストランスポーターの細胞膜への移動にも、このシグナル系が必須であることがわかってきています。
このように、MAP kinase経路、PI 3-kinase経路を介して活性化された種々のキナーゼは、転写因子や細胞機能を制御するタンパク質をリン酸化するなどして、インスリン、IGFの生理活性を発現します。しかし、これらのホルモンの広範な生理活性の発現は、ここまで紹介したシグナル伝達経路のみでは説明できない現状で、生理活性の多様性は、未知のシグナル伝達経路の存在を強く示唆しています。また、これまでに、レセプター以降のどのシグナル伝達系の差異によってインスリンとIGFの生理活性の差異が起こるのかについては、ほとんど明らかになっていません。
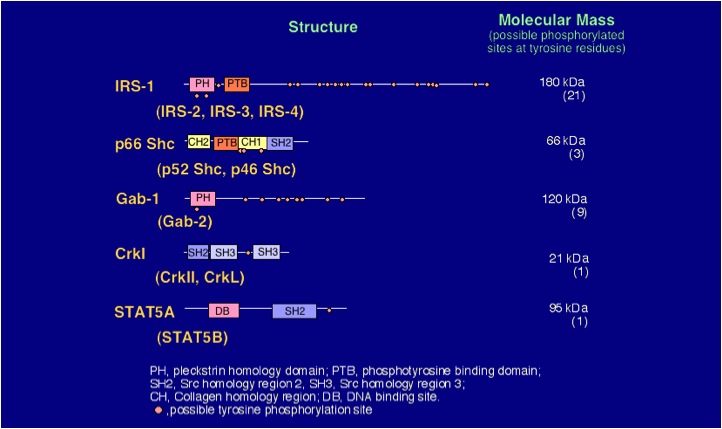
インスリンレセプター/IGF-Iレセプターに内蔵されているチロシンキナーゼは、ここにあげたようなタンパク質をチロシンリン酸化する。リガンドがインスリンレセプター/IGF-Iレセプターのαサブユニットに結合すると、βサブユニットに内蔵されているチロシンキナーゼが活性化される。このキナーゼは、自身をチロシンリン酸化し、このリン酸化チロシン残基を認識して、ここにあげたようなタンパク質のPTBドメインあるいはSH2ドメインが、このリン酸化チロシン残基を認識してレセプターに相互作用、チロシンリン酸化される。特に、IRSは、これらのレセプターキナーゼの重要な基質と考えられ、4種類の分子種の存在が明らかになっている。それぞれのIRSは、異なる生理的意義を有すると推定されている。

IGF-Iレセプター/インスリンレセプターが内蔵するチロシンキナーゼによってチロシンリン酸化された基質、IRSあるいはShcは、リン酸化チロシン残基の認識を介してSH2ドメインを有する他のシグナル分子と結合し、下流にシグナルを伝達する。SH2ドメインを有しているシグナル分子として、Grb2やPI 3-kinase p85制御サブユニットなどがあげられ、これらの分子が細胞膜近くにリクルートされることよって、ras/MAP kinase経路、PI 3-kinase/Akt経路などが活性化する。リン酸化カスケードにより、下流に伝えられたシグナルによって、多種多様なIGF、インスリンの生理活性が発現されると考えられている。
| 研究背景:目次 | インスリン様シグナル(1) 戻る 次へ インスリン様シグナル(3) |