研究背景
インスリンとIGFの細胞内シグナル伝達機構
標的細胞でインスリン、IGFがそれぞれ高い親和力で結合するレセプターとして、現在までに、4種類が知られています (表3)。 特に、インスリンレセプターとIGF-Iレセプターは、やはり相同性が高いことが明らかになっています。これらのレセプターは、ホルモンが結合するαサブユニットと、チロシンキナーゼドメインを有するβサブユニットがジスルフィド結合したダイマーが、2つ結合した4量体構造をとっています。最近になり、多くの組織で、インスリンレセプターのαサブユニットとβサブユニットのダイマーとIGF-Iレセプターの同じダイマーが会合したインスリンレセプター―IGF-Iレセプターハイブリッドが存在することが発見されました。このハイブリッドレセプターは、インスリンに比べIGF-Iに対して高い親和性を示すことが明らかになっていますが、その生理的意義については未だに不明です。また、インスリンレセプターも、インスリンに比較すると1/100程度の親和性ですがIGFとも結合し、IGF-Iレセプターもまたインスリンに低い親和性ながら結合します。インスリンレセプターあるいはIGF-Iレセプターが、インスリンあるいはIGFに高い親和性を有するのは、インスリンとIGFの構造の違いを認識しているためと考えられます。一方、IGF-IIに特異性の高いIGF-IIレセプターはマンノース6-リン酸レセプターと同一であることが明らかとなっていますが、主にIGFの分解に関わっていると考えられています。これらのレセプターは、多くの臓器で発現しており(ただし、IGF-I受容体は生後の動物では、肝臓と脂肪細胞でその発現が観察されていません)、臓器の発達状態や生理状態に応答して、その発現が調節されています。
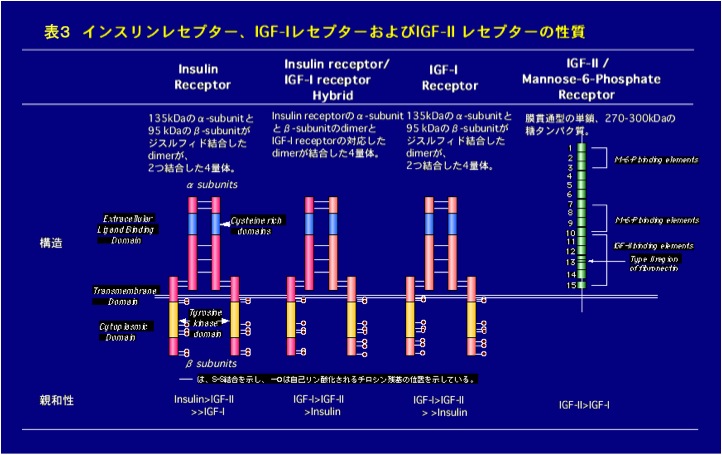
インスリンレセプターとIGF-Iレセプターも、アミノ酸配列の相同性が高く、構造も類似している。両レセプターともチロシンキナーゼ活性を介して、細胞内にシグナルを伝達する。更に、インスリンレセプターとIGF-Iレセプターのハイブリッドも存在する。レセプターに対するホルモンの親和性の違い、組織におけるレセプター発現量の違い、レセプターのC末端部分の相同性の低い領域などが、インスリンとIGFの生理活性の違いを発現するのではないかと考えられている。
| 研究背景:目次 | インスリンファミリーペプチドとは 戻る 次へ インスリン様シグナル(2) |