研究内容
プロジェクト3−1
IGFシグナルのダイナミクスの違いが細胞の運命を決定する
IGFは細胞増殖と細胞分化を誘導するホルモンであることが知られています。特に、L6筋芽細胞ではIGF-Iによって細胞増殖が誘導されますが、筋管細胞への分化にもIGF-Iの存在は必須であることが知られています。そこで私たちは、『なぜ同じホルモンIGF-Iが細胞増殖と細胞分化という一見相反するような生理活性を同じ細胞に対して誘導するのか』に興味を持ち研究を進めました。
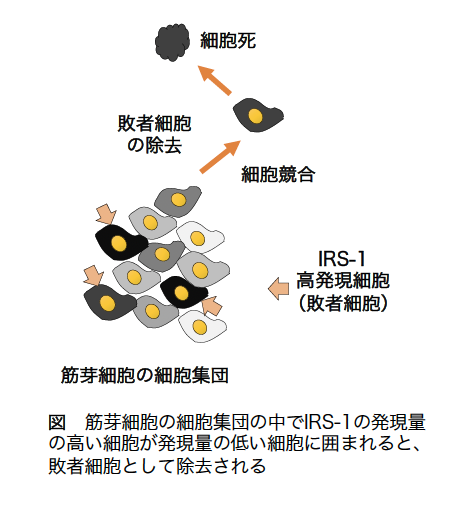
L6筋芽細胞は血清(栄養素、IGF-Iも多く含まれる)含量の多い培地で培養すると増殖しますが、血清を1/5量に低下させて培養すると筋芽細胞同士が融合して、多核の筋管細胞を形成することが知られています。その筋管細胞への分化過程でインスリン様シグナル分子の挙動を調べてみました。その結果、インスリン受容体基質(IRS-1)というタンパク質の発現量が多い細胞が、IRS-1のタンパク量が少ない細胞に囲まれると、敗者細胞として細胞集団から除去されることを明らかにしました(細胞競合)(Okino et al. Front. Endo. 2020)。
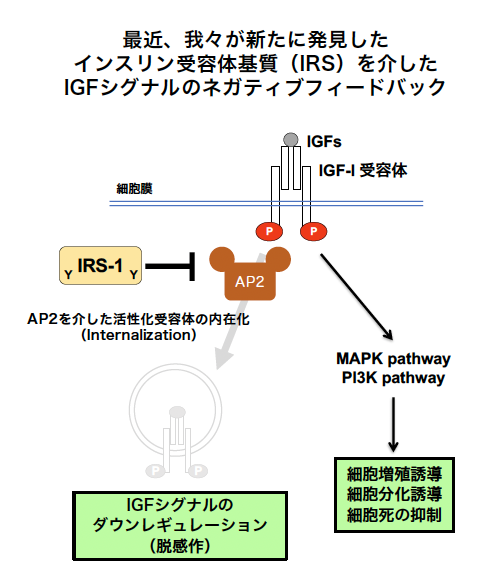
もしIGF-Iシグナルの活性がIGF-Iの濃度に依存して一定であるならば、細胞ごとのIRS-1量に違いがないはずです。したがって、私たちは実はIGF-Iシグナルは細胞内で振動しており、細胞ごとにその位相がずれているために、IRS-1の量は細胞ごとに異なるのではないかと考えました。そこで、これまでに私たちの研究室で発見していたIGF-Iシグナルの新しいネガティブフィードバック機構(Yoneyama et al. eLife 2018、Yoneyama et al. iScience 2018)をもとに数理モデルを構築して、その数理モデルをもとにラウスフルビッツの安定判別法でモデルの安定性を調べてみました。
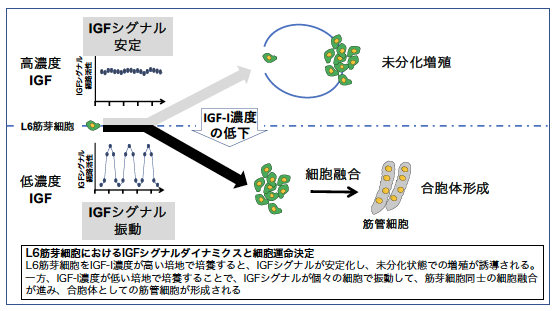
このように、IGF-Iシグナルのダイナミクスの違いが細胞が増殖するか、分化するかの運命を決定している可能性を示すことができました。
IGF-Iの血中濃度は日内変動がほとんどないことが知られていますが、IGF-Iシグナルのダイナミクスはほとんどの組織や細胞で調べられていないのが現状です。IGF-Iシグナルの活性を生きたまま検出する手法を開発して、培養細胞や動物個体でIGF-Iシグナルダイナミクスを測定することで、IGF-Iシグナルのダイナミクスが誘導する生理活性の違いについてさらに理解が深まると期待しています。
| 研究内容:目次 | プロジェクト2コラム 戻る 次へ プロジェクト3−2(1) |